Aplikasi Histologi untuk Deteksi Penyakit pada Karang
Menurut Bevelander et all (1988) histologi berasal dari bahasa yunani (histos = jaringan), adalah suatu ilmu yang menguraikan struktur dari hewan serta tumbuhan secara terinci, dan hubungan antara struktur pengorganisasian sel dan jaringan dan fungsi-fungsi yang mereka lakukan. Dan menurut Cha (2004) histologi mempelajari anatomi secara mikroskopik, di dalamnya dipelajari sel, jaringan, organ dan sistem organ baik pada hewan maupun tumbuhan. Studi pendukung dalam histologi adalah ekologi, fisiologi, reproduksi, biokimia, immunologi, embriologi dan sistematika.

Histologi dapat digunakan untuk mengetahui bagian-bagian jaringan polip pada karang melalui proses histologi.
Anatomi Karang
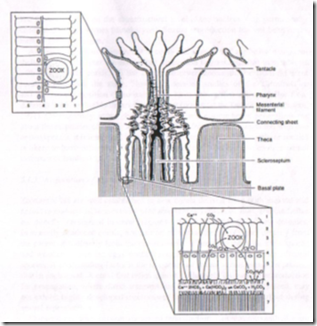
Polip karang adalah hewan sederhana yang berbentuk seperti tabung (Gambar 1). Mulut terletak di bagian atas yang sekaligus berfungsi sebagai anus. Makanan yang masuk akan dicerna oleh filament mesentery dan sisa makanan dikeluarkan melalui mulut. Jaringan karang terdiri dari ektoderm, mesoglea, dan endoderm. Ektoderm merupakan jaringan terluar dan di dalam jaringan ini dapat dijumpai adanya cilia (bulu halus), kantong mucus (lendir) dan sejumlah nematocyst. Mesoglea adalah jaringan yang mendekati homogen seperti jelly, terletak di antara ektoderm dan endoderm. Endoderm adalah jaringan yang terletak pada bagian yang paling dalam. Sebagian besar terisi oleh zooxanthella. Zooxanthella ini merupakan algae uniseluler, berwarna kuning coklat, dan hidup sebagai simbion karang (Suharsono, 1984).
Bagian yang keras berupa kerangka kapur, terdiri dari lempeng dasar yang tipis, dan disebut "basal plate". Dari lempeng dasar muncul lempeng-lempeng yang berdiri tegak secara radial dan disebut septa. Masing-masing septa dihubungkan oleh lempengan yang melingkar yang disebut theca atau dinding. Penyusun kerangka ini terdiri dari serat kristalin atau butir-butir aragonit CaCO3 yang mempunyai diameter dua mikron. Secara umum bentuk dasar kerangka kapur semua jenis karang adalah sama. Perbedaan pengendapan CaCO3 dan adanya faktor genetik memberikan bentuk-bentuk yang karakteristik pada masing-masing jenis karang (Suharsono, 1984).
Gambar 2. Anatomi polip karang (Wells, 1956).
Polip karang terdiri dari dua lapisan sel yang sederhana yaitu ektodermis (epidermis) dan lapisan endodermis (gastrodermis), dan kedua lapisan ini dipisahkan oleh jaringan penghubung yang tipis disebut mesoglea (Gambar 2) (Bikerland, 1997 dalam Muttaqin 2006 dalam Muttaqin 2006).
Ektodermis merupakan jaringan terluar yang terdiri dari berbagai jenis sel antara lain sel mucus dan nematocist. Mesoglea merupakan jaringan tengah berupa lapisan seperti jelly (Suharsono, 1996). Lapisan endodermis merupakan jaringan terdalam pada polip karang tempat hidup ribuan alga mikroskopik yang disebut zooxanthellae yang secara alami hidup bersimbiosis dengan hewan karang (Burke et al., 2002 dalam Muttaqin 2006).
Sumber: Birkeland (1997) dalam Muttaqin (2006)
Gambar 3. Anatomi hewan karang.1) Air laut di rongga gastrovaskular; (2) Gastrodermis; (3) Zooxanthellae pada gastrodermis; (4) Mesoglea; (5) Epidemis; (6) Matriks dengan endapan kalsium karbonat; (7) Skeleton
Proses Histologi Pada Karang
Proses histologi karang menurut Cha (2004) yaitu Collecting, Fixation, Decalcifyng and trimming, Embedding, Sectioning dan Staining.
1) Collecting
- Menggunakan (chisel) pahat dingin dan perangkat coring (untuk koloni besar)
- Rileks dalam mengumpulkan spesimen yang
- Memperoleh izin sebelum melakukan studi
2) Fixation,
Untuk menghindarkan pencernaan jaringan oleh enzim-enzim (otolisis) atau bakteri dan untuk melindungi struktur fisik, potongan organ harus diperlakukan dengan tepat dan memadai sebelum atau secepat mungkin. Zat-zat kimia yang digunakan untuk memfiksasi jaringan disebut fiksatif (Junqueira et all, 1980).
Sedangkan Menurut Cha (2004) adalah :
- Untuk memelihara struktur dan komposisi dari jaringan
- Efek Bedah biasanya dicegah dengan mempercepat denaturing dan protein, atau dengan memberi protein dengan aldehida dan/atau bahan kimia lain
- Fiksatif pilihan akan tergantung pada media embedding yang akan digunakan
- Untuk mikroskopi cahaya, parafin embedding: Modifikasi Helly, Bouin, dan 10% Formalin dalam air laut
- Untuk mikroskop elektron hanya: Glutaraldehid / Paraformaldehyde
Metode fiksasi yang memenuhi kriteria menurut Bevelander et all (1988) adalah sebagai berikut :
- Distorsi (kerusakan bentuknya) harus seminimal mungkin.
- Fiksatifnya, jika mungkin, jangan sampai melarutkan komponen-komponen jaringan.
- Fiksatifnya harus dapat mencegah pembusukan (yakni karena bakteri) dan harus dapat menghentikan kegiatn enzim-enzim sel yang dapat menyebabkan otodigesti (perusakan diri sendiri)
- Fiksatifnya harus dapat mempertahankan sel dan jaringannya dalam posisi semula sehingga jaringan itu dapat diiris menjadi sayatan-sayatan yang cukup tipis untuk memungkinkan terlihatnya bagian-bagian terkecil.
3) Decalcifyng and trimming,
- Menanamkan spesimen decalcification sebelum menggunakan 1 -1,5% dengan titik leleh rendah atau agarosa HistoGel (Opsional)
- Decalcifying larutan asam klorida dengan agen Chelating, etilen diamina tetraacetic acid (EDTA)
4) Embedding,
Agar dapat memperoleh potongan tipis dengan mikrotom, setelah fiksasi jaringan harus diinfiltrasi dengan suatu zat yang dapat memberi suatu konsistensi kuat yang diperlukan untuk pemotongan. Ini dapat berupa gelatin, seloidin, parafin, atau bahkan liat lainnya. Parafin umum digunakan untuk mikroskop cahaya (Junqueira et all, 1980).
Sedangkan Menurut Cha (2004) adalah :
- Dehidrasi untuk menghapus semua jejak-jejak air
- Infiltrasi dengan cairan yang dapat mengeras cukup untuk memungkinkan pemotongan bagian tipis
- Clear dengan reagen yang bercampur dengan larutan dehidrasi dan menengah embedding
- Menanamkan media: Parafin untuk cahaya mikroskop & Glycol metakrilat atau epoksi untuk mikroskopi elektron
- Topologi jaringan
Gambar 4. (Humason, 1967 dalam Cha, 2004)
5) Sectioning
- Potong bagian di 6-10 mikrometer atau lebih tipis
- Hapus keriput dan gelembung udara dari pita oleh mengambang di air hangat
- Seperangkat mengambil bagian adalah pada slide dan kering
Gambar 5. (Humason, 1967 dalam Cha, 2004)
Gambar 6. (Humason, 1967 dalam Cha, 2004)
Gambar 7. (Humason, 1967 dalam Cha, 2004)
6) Staining
- Untuk memvisualisasikan sel dan komposisi dan struktur jaringan
- Noda digunakan untuk membedakan berbagai komponen sel dan jaringan; mereka mengikat preferentially tergantung pada biokimia dari organel, membran, dll
Prosedur Kerja Histologi Karang Galaxea
a. Fiksasi
Membersihkan wadah botol kaca kecil sebanyak satu buah untuk preparat organ gonad karang Galaxea sp dengan menggunakan aquades dan mengeringkannya dengan menggunakan tissue rol. Meletakkan preparat ginjal yang telah dipotong tipis/kecil, dan memasukkan larutan HCL secukupnya kedalam wadah yang sudah berisi preparat hingga terendam seluruhnya selama 24 jam.
b. Washing
Mengeluarkan organ karang dari larutan HCL yang dipakai pada proses fiksasi. Kemudian memasukkannya kedalam alkohol 70% secukupnya hingga sampel terendam seluruhnya. Untuk memaksimalkan pengeluaran HCL, maka botol sampel yang didalamnya terdapat preparat yang, digerak-gerakkan naik turun secara berulang-ulang. Tahapan ini berlangsung selama 2x15 menit.
c. Dehidrasi
Mengganti alkohol 70% yang dipakai pada proses washing, dengan alkohol 70% yang baru kedalam botol sampel sehingga potongan sampel terendam seluruhnya. Selanjutnya secara bertahap alkohol 70% diganti dengan alkohol 80%, dan 96%. Pada masing-masing tahapan dehidrasi, direndam dengan durasi masing-masing 2X15 menit.
d. Clearing
Mengeluarkan Alkohol 96% dari wadah dengan menggunakan pipet tetes, kemudian menggantinya dengan larutan xylene kedalam wadah secukupnya hingga preparat terendam seluruhnya selama 2x15 menit
e. Impregnasi
Jaringan polip yang telah direndam dalam larutan xylene, dipindahkan ke dalam cassete dan deckle, cassete dan deckle yang telah berisi jaringan dimasukkan kedalam moldtray yang memiliki 3 wadah. Memasukkan preparat kedalam wadah I yang mengandung xylene dan parafin murni dengan perbandingan 1 : 1 selama 30 menit, memasukkan preparat ke wadah II yang mengandung parafin cair selama 30 menit, dan selanjutnya memasukkan preparat ke wadah III yang juga berisi parafin cair selama 30 menit.
f. Embeding
Jaringan polip yang sudah diimpregnasi diletakkan dalam lempengan blok (dibagian worksurf dari Histoembedder) dengan posisi yang sudah diatur sedemikian rupa. Kemudian lempengan blok ini diisi dengan parafin cair dan ditutup dengan cassette dan deckle, kemudian didinginkan di cold plate selama 5-10 menit atau sampai parafin mengeras.
g. Cutting
Proses pemotongan ini dilakukan dengan menggunakan mikrotom. Sampel dipotong dengan ketebalan 5-7 mikrometer. Preparat yang telah dipotong diletakkan di objek glass, kemudian ditetesi aquades dan diletakkan di atas penangas air selama + 24 jam.
h. Staining
Memasukkan jaringan ke dalam xylene selama 2x15 menit, kemudian di dehidrasi dengan alkohol berkonsentrasi tinggi ke konsentrasi rendah yaitu alkohol 96%, alkohol 80% dan alkohol 70% masing-masing selama 10 menit. Kemudian jaringan direndam dalam aquades selama 10 menit, setelah itu jaringan dimasukkan dalam pewarna Haematoksilin selama 20 menit, kemudian jaringan dimasukkan dalam eosin selama 1 menit, lalu di dehidrasi dari alkohol konsentrasi rendah ke tinggi 70%, 80%, dan 96% masing-masing selama 10 menit.
i. Mounting
Proses terakhir ini yakni jaringan ini dicelupkan ke dalam xylene dan ditiriskan, lalu objek glass diberi entelan dan ditutup dengan deglass, kemudian diamati dibawah mikroskop.
Contoh Preparat Histologi Karang Galaxea sp.
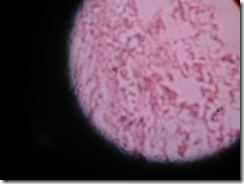
Gambar 8. Preparat histologi Galaxea sp.
Pada gambar terlihat adanya mesoglea, ektodermis, endodermis dan zoxanthella. Pada gambar histologi Galaxea sp. di atas tidak dapat ditentukan apakah terdapat penyakit atau tidak karena tidak adanya gambar pembanding yang menunjukkan mana spesies Galaxea yang normal dan mana yang berpenyakit.
Sumber Rujukan:
- Bevelander, Gerrit; Ramaley, Judith A. 1988. Dasar-dasar Histologi. Jakarta. Penerbit Erlangga.
- Cha, Ha-Rim. 2004. Understanding Coral Histology - How & Why - http://www.nhm.ku.edu/inverts/presentations2004/harim_museumlunch_april2004.ppt [Diakses pada tanggal 25 Maret 2010]
- Junqueira, Luis C; Carneiro, Jose. 1980. Hisrologi Dasar (Basic Histology).Jakarta: EGC.
- Muttaqin, Efin. 2006. Kondisi Ekosistem Terumbu Karang Pada Tahun 2002 Dan Tahun 2005 Di Daerah Perlindungan Laut Pulau Sebesi Lampung. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. .
- Suharsono. 1984. Pertumbuhan Karang. Oseana Volume IX Nomor 2 : 41 – 48.
- Timotius, Silvianita. 2010. Biologi Terumbu Karang. www.terangi.or.id/biologiterumbukarang.pdf. [Diakses tanggal 12 April 2010]









No comments